Larutan Elektrolit dan Konsep Redoks
Minggu, 29 April 2018
LARUTAN ELEKTROLIT & NONELEKTROLIT
Pada tahun 1884, Svante Arrhenius, ahli kimia terkenal dari Swedia mengemukakan teori elektrolit yang sampai saat ini teori tersebut tetap bertahan padahal ia hampir saja tidak diberikan gelar doktornya di Universitas Upsala, Swedia, karena mengungkapkan teori ini. Menurut Arrhenius, larutan elektrolit dalam air terdisosiasi ke dalam partikel-partikel bermuatan listrik positif dan negatif yang disebut ion (ion positif dan ion negatif) Jumlah muatan ion positif akan sama dengan jumlah muatan ion negatif, sehingga muatan ion-ion dalam larutan netral. Ion-ion inilah yang bertugas mengahantarkan arus listrik. Larutan yang dapat menghantarkan arus listrik disebut larutan elektrolit.
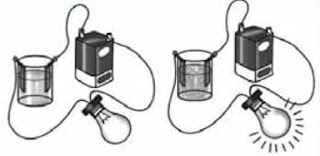
Larutan ini memberikan gejala berupa menyalanya lampu atau timbulnya gelembung gas dalam larutan.
Larutan elektrolit mengandung partikel-partikel yang bermuatan (kation dan anion). Berdasarkan percobaan yang dilakukan olehMichael Faraday, diketahui bahwa jika arus listrik dialirkan ke dalam larutan elektrolit akan terjadi proses elektrolisis yang menghasilkan gas. Gelembung gas ini terbentuk karena ion positif mengalami reaksi reduksi dan ion negatif mengalami oksidasi. Contoh, pada laruutan HCl terjadi reaksi elektrolisis yang menghasilkan gas hidrogen sebagai berikut.
HCl(aq)→ H+(aq) + Cl-(aq)
Reaksi reduksi : 2H+(aq) + 2e- → H2(g)
Reaksi oksidasi : 2Cl-(aq) → Cl2(g) + 2e-
Larutan elektrolit terbagi menjadi 2 macam, yaitu elektrolit kuat dan larutan elektrolit lemah
Pada larutan elektrolit kuat, seluruh molekulnya terurai menjadi ion-ion (terionisasi sempurna). Karena banyak ion yang dapat menghantarkan arus listrik, maka daya hantarnya kuat. pada persamaan reaksi, ionisasi elektrolit kuat ditandai dengan anak panah satu arah ke kanan.
Contoh :
NaCl(s) → Na+ (aq) + Cl- (aq)
Contoh larutan elektrolit kuat :
Asam, contohnya asam sulfat (H2SO4), asam nitrat (HNO3), asam klorida (HCl)
Basa, contohnya natrium hidroksida (NaOH), kalium hidroksida (KOH), barium hidroksida (Ba(OH)2)
Garam, hampir semua senyawa kecuali garam merkuri
Larutan elektrolit lemah adalah larutan yang dapat memberikan nyala redup ataupun tidak menyala, tetapi masih terdapat gelembung gas pada elektrodanya. Hal ini disebabkan tidak semua terurai menjadi ion-ion (ionisasi tidak sempurna) sehingga dalam larutan hanya ada sedikit ion-ion yang dapat menghantarkan arus listrik. Dalam persamaan reaksi, ionisasi elektrolit lemah ditandai dengan panah dua arah (bolak-balik).
Contoh :
CH3COOH(aq) ↔ CH3COO- (aq) + H+ (aq)
Contoh senyawa yang termasuk elektrolit lemah :
CH3COOH, HCOOH, HF, H2CO3, dan NH4OH
Larutan elektrolit dapat bersumber dari senyawa ion (senyawa yang mempunyai ikatan ion) atau senyawa kovalen polar (senyawa yang mempunyai ikatan kovalen polar)
Sedangkan larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik dan tidak menimbulkan gelembung gas. Pada larutan non elektrolit, molekul-molekulnya tidak terionisasi dalam larutan, sehingga tidak ada ion yang bermuatanyang dapat menghantarkan arus listrik.
Contoh : larutan gula, urea
KONSEP REAKSI OKSIDASI REDUKSI (REDOKS)
Jejaring Kimia – Berbagai macam reaksi kimia tanpa kita sadari, begitu akrab dengan kehidupan kita.
Pernahkah Anda melihat besi maupun seng berkarat?
Benda perhiasan yang disepuh kembali karena warnanya yang pudar?
Energi listrik yang ditimbulkan oleh aki kendaran bermotor?
Atau yang lebih sederhana ketika kita mengupas buah apel, beberapa saat akan terjadi perubahan warna. Mengapa hal itu bisa terjadi?
Semua kejadian atau peristiwa di atas merupakan contoh dari reaksi oksidasi atau reduksi yang akrab kita sebut sebagai reaksi redoks.
Sesuai dengan perkembangannya, ada tiga konsep untuk menjelaskan reaksi oksidasi reduksi (redoks). Konsep tersebut adalah sebagai berikut:
Konsep redoks berdasarkan pelepasan dan pengikatan oksigen.
Konsep redoks berdasarkan pelepasan dan penerimaan elektron.
Konsep redoks berdasarkan kenaikan dan penurunan bilangan oksidasi.
Berikut penjelasan sederhana untuk ketiga konsep reaksi oksidasi reduksi (redoks) di atas.
Redoks berdasarkan pelepasan dan pengikatan oksigen.
Berdasarkan konsep pertama:
a. Oksidasi adalah peristiwa pengikatan oksigen
Adapun contoh yang terkait dengan reaksi oksidasi berdasarkan konsep ini adalah sebagai berikut:
1) Perkaratan logam besi
Reaksi perkaratan logam besi:
4Fe(s) + 3O2(g) –> 2Fe2O3(s) [karat besi]
2) Pembakaran bahan bakar (misalnya gas metana, minyak tanah, LPG, solar)
Reaksi pembakaran gas metana (CH4): akan menghasilkan gas karbon dioksida dan uap air.
CH4(g) + O2(g) –> CO2(g) + 2H2O(g)
3) Oksidasi glukosa (C6H12O6) dalam tubuh (respirasi). Di dalam tubuh, glukosa di pecah menjadi senyawa yang lebih sederhana seperti carbon dioksida dan air.
C6H12O6(aq) + 6O2(g) –> 6CO2(g) + 6H2O(l)
4) Oksidasi tembaga Cu, belarang S, dan belerang dioksida SO2:
Cu(s) + O2(g) –> CuO(s)
S(s) + O2(g) –> SO2(g)
SO2(g) + O2(g) –> SO3(g)
5) Buah apel maupun pisang setelah dikupas akan berubah warna menjadi kecoklatan
6) Minyak makan yang disimpan terlalu lama dan dalam kondisi terbuka akan menyebabkan bau tengik hasil dari pengikatan oksigen (teroksidasi)
7) Menurut Anda, contoh apa lagi yang terkait dengan peristiwa oksidasi berdasarkan konsep pertama? Silakan tambahkan di sini !!
Zat yang mengikat oksigen kita sebut sebagai reduktor/pereduksi. Berdasarkan contoh-contoh reaksi oksidasi di atas, maka reduktor untuk reaksi: 1) Besi Fe; 2) Metana CH4; 3) Glukosa C6H12O6; 4) Cu, S, SO2
b. Reduksi adalah peristiwa pelepasan oksigen (kebalikan dari reaksi oksidasi)
Adapun contoh yang terkait dengan reaksi reduksi berdasarkan konsep ini adalah sebagai berikut:
1) Reduksi mineral hematit F2O3 oleh karbon monoksida CO
F2O3(s) + CO(g) –> 2Fe(s) + CO2(g)
2) Reduksi kromium(III) oksida Cr2O3 oleh aluminium Al
Cr2O3(s) + 2Al(s) –> 2Cr(s) + Al2O3(s)
3) Reduksi tembaga(II) oksida CuO oleh gas hidrogen H2
CuO(s) + H2(g) –> Cu(s) + H2O(g)
4) Reduksi SO3, KClO3, dan KNO3:
SO3(g) –> SO2(g) + O2(g)
3KClO3(s) –> 2KCl(s) + 3O2(g)
2KNO3(aq) –> 2KNO2(aq) + O2(g)
Zat yang melepas oksigen kita sebut sebagai oksidator/pengoksidasi. Berdasarkan contoh-contoh reaksi reduksi di atas, maka oksidator untuk reaksi: 1) Hematit Fe2O3; 2) Kromium(III) oksida Cr2O3; 3) Tembaga(II) oksida CuO; 4) SO3, KClO3, KNO3.
2. Konsep redoks berdasarkan pelepasan dan penerimaan elektron.
Pelepasan dan penerimaan elektron terjadi secara simultan, artinya jika suatu spesi melepas elektron berarti ada spesi lain yang menyerapnya. Hal ini berlaku untuk ikatan kimia. Silakan Anda hubungkan dengan materi ikatan kimia kelas X semeser I.
Berdasarkan konsep yang kedua:
a. Oksidasi adalah peristiwa pelepasan elektron
b. Reduksi adalah penerimaan elektron
Adapun contoh yang terkait dengan reaksi oksidasi dan reduksi berdasarkan konsep ini adalah sebagai berikut:
1) Reaksi natrium dengan clorin membentuk natrium klorida NaCl
Oksidasi : Na –> Na+ + e [melapas 1 elektron]
Reduksi : Cl + e –> Cl– [menerima 1 elektron]
————————————-
Na + Cl –> Na+ + Cl– –> NaCl
2) Reaksi kalsium dengan belerang membentuk calsium sulfida
Oksidasi : Ca –> Ca2+ + 2e [melepas 2 elektron]
Reduksi : S + 2e –> S2- [menerima 2 elektron]
————————————-
Ca + S –> Ca2+ + S2- –> CaS
Zat yang melepas elektron (oksidasi) disebut reduktor, sedangkan zat yang menerima elektron (reduksi) disebut oksidator.
3. Konsep redoks berdasarkan kenaikan dan penurunan bilangan oksidasi.
Dalam berbagai kasus reaksi oksidasi yang kompleks, sulit untuk menentukan spesi mana yang mengalami oksidasi dan reduksi. Contoh reaksi berikut:
2KMnO4 + 3H2SO4 + H2C2O4 –> K2SO4 + 2MnSO4 + 2CO2 + 4H2O
Dapatkah Anda menyebutkan spesi mana yang mengalami reaksi oksidasi dan reduksi?
Untuk menjawab pertanyaan ini, maka digunakan konsep reaksi oksidasi reduksi berdasarkan kenaikan dan penurunan bilangan oksidasi (biloks).
Berdasarkan konsep yang ketiga
a. Oksidasi adalah pertambahan biloks
b. Reduksi adalah penurunan biloks
Sumber : davitinity